ویدئوی شناخت بهتر فلزات

به طور کلی در علوم مهندسی مواد به 4 دسته اصلی تقسیم میشوند. فلزات، پلیمرها، سرامیکها و کامپوزیتها. درک انواع مختلف مواد، خواص آنها و نحوه استفاده بهینه از آنها بخش مهمی از علوم مهندسی است. در این مقاله ما به بررسی چند فلز مهم و پرکاربرد میپردازیم. با ساختار میکروسکوپی آنها آشنا میشویم و تکنیکهای مختلف مانند آلیاژسازی و عملیات حرارتی که میتواند باعث بهبود خواص و ویژگی آنها شوند را بررسی مینماییم.
فلزات مهم
تقریبا دو سوم عناصر در جدول تناوبی عناصر فلز هستند. البته در مقاصد مهندسی تنها تعداد اندکی از آن ها کاربرد فراوان دارند و در این مقاله ما علاقه مند به صحبت در مورد این تعداد اندک فلز هستیم. آهن مطمئنا مهمترین این فلزات است، به این خاطر که آن برای ساخت فولاد یا استیل (Steel) استفاده میشود. فلزی با استحکام و مقاومت بالا که در کاربردهای مهندسی فراوانی مورد استفاده قرار میگیرد. آلومینیوم فلز مهم و پرکاربرد دیگری است. آلیاژهای آلومینیوم به نسبت وزنی که دارند دارای استحکام و مقاومت بالایی هستند. آلومینیوم دمای ذوب نسبتا پایینی دارد (660 درجه سانتیگراد) که از این جهت فلز مناسبی در فرآیندهای تولید و قالب گیری است. علاوه بر این ویژگیهای مثبت، آلومینیوم فلزی نسبتا ارزان است. مانند آلومینیوم، تیتانیوم هم فلزی است که به نسبت وزن خود استحکام و مقاومت فوقالعادهای دارد. از آنجایی که تیتانیوم حتی از آلیاژهای آلومینیوم محکمتر است، گزینه بسیار مناسبی برای استفاده در تجهیزات هوانوردی و فضایی است. دمای ذوب بالای آن (1668 درجه سانتیگراد) باعث شده است این فلز برای استفاده در تجهیزاتی که در زمان کار در دمای بسیار بالا قرار میگیرند مناسب باشد. البته این دمای ذوب بالا باعث میشود که فرآیندهای تولید آن سختتر گردد. علاوه بر این تیتانیوم بسیار گرانتر از آلومینیوم است. دیگر فلزات پرکاربرد شامل منیزیم، مس و نیکل هستند. منیزیم دمای ذوب نسبتا پایینی دارد (650 درجه سانتیگراد) که باعث میشود قالب گیری و پروسههای تولید آن ساده باشد. این فلز در ساخت قطعات اتوموبیل کاربرد فراوان دارد. مس فلز پرکاربرد دیگری است که از آن آلیاژهای مهمی مانند برنز (در اثر اختلاط مس و قلع) و برنج (در اثر اختلاط مس با روی) ساخته میشود. نیکل فلزی است که در مقابل خوردگی مقاومت بالایی دارد. این فلز نقطه ذوب بالایی (1455 درجه سانتیگراد) دارد و به همین دلیل در ساخت تجهیزاتی که باید در دمای بالا کار کنند به کار میرود. در شکل روبرو چند نوع فلز معروف نشان داده شده است. از بالا به پایین و سمت چپ به راست این فلزات عبارتند از:
فولاد، آهن، برنز، برنج، آلومینیوم، مس، کروم، طلا، سرب، نقره، منیزیم، قلع، نیکل، تیتانیوم و روی

ساختار اتمی فلزات
نکته کلیدی برای استفاده بهینه از این فلزات، درک ساختار آنها در مقیاس اتمی است. اتمهای یک فلز خالص به صورت متراکم و بسیار منظمی در کنار هم قرار گرفتهاند. به خاطر این قرارگیری منظم در کنار هم به یک فلز، یک ماده کریستالی (Crystalline Materials) گفته میشود. همچنین به ساختاری که اتمها در یک فلز در کنار هم به طور منظم چیده شده اند، شبکه کریستالی گفته میشود. تمام مواد ساختاری منظمی مانند ساختار کریستالی را ندارند. به طور مثال در شیشه اتمها به صورت تصادفی و بدون نظم در کنار هم قرار گرفتهاند. این نوع مواد کریستالی نیستند و به آنها، مواد آمورفی (Amorphous Materials) گفته میشود.
ساختار کریستالی را میتوانیم به صورت تکرار یک واحد کوچک در تمام جهات در نظر بگیریم. به آن واحد کوچک، واحد سلولی (Unit Cell) گفته میشود. اتمهای فلزات در شکلهای مختلفی میتوانند در کنار هم قرار بگیرند. بنابراین در فلزات شکلهای مختلفی از واحد سلولی وجود دارند. این شکلهای مختلف واحد سلولی در تصویر مقابل نشان داده شدهاند.

در واحد سلولی فلز مس، در هر راس واحد سلولی یک اتم و در وسط هر وجه هم یک اتم مس قرار گرفته است. این مساله را میتوان با کوچکتر نشان دادن اتمها و نمایش پیوندهای بین آنها بهتر مشاهده کرد. به این نوع ساختار که اتمهای فلز مس طبق آن در کنار هم قرار گرفته اند، ساختار مکعبی مرکز وجهی یا FCC (Face-Centered Cubic) گفته میشود. این ساختار در ویدئوی مقابل تصویر شده است.
اما اتمهای آهن ترجیح میدهند به شکلی دیگر در کنار هم قرار بگیرند. در واحد سلولی آهن به جای قرار گرفتن یک اتم در وسط هر وجه تنها یک اتم در مرکز مکعب واحد سلولی قرار دارد. به این نوع ساختار، ساختار مکعبی مرکز سلولی یا BCC (Body-Centered Cubic) گفته میشود. این ساختار در ویدئوی مقابل نشان داده می شود.
اتمهای تیتانیوم در کنار هم به شکلی که به آن ساختار هشتایی متراکم یا HCP (Hexagonal Close Packed) گفته میشود قرار میگیرند. در ویدئوی مقابل شکل این نوع ساختار اتمی نشان داده شده است.
این سه ساختار، معمولترین ساختارهای اتمی در فلزات هستند. هر دوی ساختارهای FCC و HCP ضریب تراکم (Packing Factor) 74 درصد را دارند. به این معنی که در این ساختار اتمی، اتمهای داخل یک واحد سلولی 74 درصد کل فضای یک واحد سلولی را اشغال کردهاند. ساختار BCC تراکم اندکی کمتر را دارد. ضریب تراکم برای این ساختار 68 درصد است. ضریب تراکم بالا در شبکه فلزات یکی از مهمترین دلایلی است که فلزات چگالی بسیار بالاتری نسبت به مواد دیگر دارند.
نقصهای شبکه کریستالی فلز
نقص نقطهای
در واقعیت شبکههای اتمی به صورت یک شکل یکپارچه و بینقص نیستند، بلکه دارای نقصهایی هستند. این نقصها انواع مختلفی دارند. نقص فضای خالی (Vacency Defect)، نقص بین نشینی (Interstitial Defect) و نقص جایگزینی (Substitutional Defect) از این نقصها هستند. نقص فضای خالی زمانی رخ میدهد که یک اتم در نقطهای از شبکه در جای خود نباشد، گویی که حذف شده است. نقص بیننشینی زمانی رخ میدهد که یک اتم خود را بین اتمهای منظم شبکه به زور جا داده باشد، به طوری که باعث به هم ریختگی نظم شبکه شود. چون اتمی که خارج از نظم شبکه خود را بین اتمهای دیگر قرار داده است از همان نوع اتم شبکه است، به این نوع نقص بیننشینی، خود بیننشینی (Self-Interstitial Defect) گفته میشود. این بیننشینی میتواند توسط اتمهای یک عنصر دیگر که برای این شبکه یک ناخالصی به حساب میآید، صورت گیرد. نوع دیگر نقص، نقص جایگزینی است که در آن تعدادی از اتمهای شبکه فلز با اتمهای یک عنصر دیگر جایگزین میشوند. تمام این سه نقصی که معرفی شد به عنوان نقصهای نقطهای در نظر گرفته میشوند. چرا که در همه این سه نقص در نقطهای خلاف نظم شبکه اتمی یا حذف شده یا اضافه شده و یا جایگزین شده است.

نقص خطی یا نابجایی
شبکههای فلزی دارای نقصهای دیگری نیز به نام نقصهای خطی (Linear Defect) یا نابجایی (Dislocation) هستند. در نابجایی تعدادی از اتمها نسبت به جای معمول خود در شبکه منظم جابجا شدهاند. یک نوع نابجایی، نابجایی مرزی یا لبهای (Edge Dislocation) است. در این نوع نابجایی یک ردیف اتم اضافی در قسمتی از شبکه در بین ساختار منظم قرار گرفته است. در صورتی که پیوند بین اتمها را در نظر بگیریم میبینیم که این یک ساختار پایدار است. اما زمانی که تنشی به شبکه وارد میشود، پیوندهای اتمی بعضی از اتمها قطع و دوباره با اتم کناری برقرار میشوند. این جابجایی پیوندها باعث میشود ردیف اتمی اضافی در طول جسم جابجا شود. نوع دیگری از نابجایی، نابجایی مارپیچی (Screw Dislocation) است. در این نابجایی یک بلوک کامل اتمی در جسم نسبت به مکان معمول خود در شبکه منظم جابجا شدهاست. به این نابجایی، نابجایی مارپیچی گفته میشود، به این دلیل که اگر مسیر اتمها را دورتادور نابجایی موجود در نظر بگیریم، شکل یک مارپیچ را خواهیم دید. شکلی شبیه رزوههای یک پیچ. در اینجا نیز اگر نیرویی برشی به جسم وارد شود اتمها به شکل پایدار جدیدی تغییر مکان میدهند.

بیشتر نابجاییهایی که در واقعیت وجود دارند ترکیبی از نابجاییهای مرزی و مارپیچی هستند. از آنجایی که در نابجاییها، نابجایی با قطع یک پیوند اتمی و برقراری دوباره پیوند اتمی دیگر در طول جسم حرکت میکند، تغییری که در شبکه اتمی رخ میدهد برگشتپذیر نیست. به عبارت دیگر یک نابجایی بعد از حذف تنش خارجی به حالت قبلی برنمیگردد. این رفتار در مقیاس اتمی دلیل زمینهای تغییر شکل پلاستیکی (Plastic Deformation) در فلزات است. تغییر شکل پلاستیکی در واقع جابجایی تعداد زیادی نابجایی در مقیاس اتمی است. از طرف دیگر تغییر شکل ارتجاعی (Elastic Deformation) وابسته به کشیده شدن پیوندهای اتمی است نه قطع شدن و دوباره برقرار شدن آنها. برعکس حرکت نابجاییها، این کشش بعد از حذف تنش به صورت کامل از بین میرود و اتمها به مکان اولیه خود باز میگردند. در نتیجه تغییر شکل ارتجاعی برگشتپذیر است.
نمودار روبرو نشان میدهد که چگونه مقاومت تسلیم در یک فلز با تراکم نابجایی تغییر میکند. موادی که در ساختار اتمی آنها تعداد زیادی نابجایی ایجاد شده است مقاومت بیشتری پیدا میکنند. به این دلیل که نابجاییهای مختلف به نوعی در هم گیر میکنند و در هم تنیده میشوند. این وضعیت اجازه نمیدهد که یک نابجایی خاص به راحتی در طول شبکه اتمی جسم جابجا شود. در نتیجه مقاومت تسلیم فلز افزایش مییابد.

حوزهها یا دانههای شبکه اتمی فلز
علاوه بر این، حرکت نابجاییها در طول یک شبکه اتمی به این که اتمها به چه شکلی در کنار هم قرار گرفتهاند نیز بستگی دارد. نابجایی در راستای صفحاتی که در آن صفحات در شبکه اتمی، اتمها در فاصله نزدیکتری نسبت به هم قرار دارند سادهتر است. به این دلیل که اتمهای نزدیکتر به هم، راحتتر میتوانند یک پیوند را قطع کنند و پیوند اتمی دیگری را برقرار نمایند. این مساله به تراکم اتمی متفاوت واحد سلولی در راستای صفحات مختلف مرتبط است. در واقعیت حتی فلزات خالص نیز در فواصل مکانی زیاد در طول جسم، روال ساختار کریستالی منظم خود را حفظ نمیکنند. یک فلز مذاب را در نظر بگیرید. با خنک شدن فلز اتمها در قسمتهای مختلف جسم به طور همزمان تشکیل زیرشبکههایی میدهند. هر یک از این زیرشبکهها راستا و جهت خود را دارند. هر چه فلز بیشتر سرد میشود قسمتهای بیشتری از فلز به صورت جامد در میآید و زیرشبکههای مختلف تشکیل شده بزرگتر و بزرگتر میشوند. در نهایت فلز جامد به صورت یک شبکه پیوسته در میآید، اما با زیرشبکههایی که در راستاها و جهتهای مختلف قرار گرفتهاند. در تصویر مقیاس طولی نشان داده شده است تا درکی از اندازه این زیرشبکهها به دست آید. به این معنی که ابعاد هر کدام از این زیرشبکهها میتوانند چیزی در حدود ده میکرومتر یا کمی بیشتر یا کمتر باشند. به هر یک از این زیرشبکهها در ساختار شبکه فلز یک حوزه یا دانه (Grain) میگویند و به ماده تشکیل شده از این حوزهها ماده چندکریستالی یا پلیکریستالی (Polycrystalline) گفته میشود. این حوزهها توسط مرزهایی از هم جدا شدهاند. در هر حوزه نابجایی در راستایی خاص راحتتر قابل انجام است. از آنجایی که شبکه فلز متشکل از حوزههایی در راستاهای مختلف است وجود حوزهها با راستاهای متفاوت از حرکت نابجاییها جلوگیری میکنند. در نتیجه ماده چند کریستالی نسبت به مادهای که یک کریستال یک پارچه در یک راستا دارد، دارای مقاومت بیشتری است.

هر چه حوزههای تشکیل دهنده شبکه فلز کوچکتر باشند، فلز محکمتر خواهد بود. این مساله در معادله Hall-Petch نشان داده شده است. معادله Hall-Petch مقاومت تسلیم فلز را بر حسب ابعاد حوزهها تعیین میکند. در این معادله d که متوسط بعد حوزه است توان 5/0 – دارد. در نتیجه هر چه d کوچکتر باشد d به توان 5/0 – عددی بزرگتر است. بنابراین با توجه به این معادله هر چه d یعنی اندازه متوسط بعد حوزه کوچکتر باشد، مقاومت تسلیم فلز بیشتر است.

کنترل اندازه ابعاد حوزههای شبکه اتمی فلز
بر اساس معادله Hall-Petch میتوانیم با کنترل اندازه حوزههای شبکه فلز در زمان خنک شدن و به حالت جامد در آمدن، مقاومت فلز را افزایش دهیم. برای افزایش مقاومت فلز ناخالصیهایی که به آن ماده تلقیحی (Inoculant) میگویند میتوانند به فلز مذاب اضافه شوند. در این حالت در زمان خنک سازی و جامد شدن تشکیل حوزهها نسبت به فلز خالص در مکانهای بیشتری رخ میدهند. در نتیجه اندازه ابعاد حوزهها کوچکتر میشوند. راه دیگری که کوچکتر شدن حوزهها به آن بستگی دارد این است که فلز با چه سرعتی سرد میشود. اگر فلز مذاب به سرعت سرد شود تشکیل حوزهها در مکانهای بیشتری رخ میدهد و کریستال زمان کافی برای رشد ندارد. در نتیجه شبکه فلز سرد شده شامل حوزههای کوچکتری میشود و در نتیجه فلز مقاومت بیشتری پیدا خواهد کرد. کنترل کردن اندازه حوزهها در شبکه یک فلز برای افزایش مقاومت آن مقاوم سازی محدوده حوزه (Grain Boundary Strengthening) نامیده میشود. این روش تنها یکی از چندین روش مقاوم سازی فلز است. یک فلز را همچنین میتوان با تغییر شکل پلاستیکی دادن آن مقاوم سازی کرد. این کار با استفاده از روش نورد سرد (Cold Rolling) یا روش فورجینگ (Forging شکل دادن فلز با گرم کردن و ضربه زدن به آن) قابل انجام است. در این روشها تعداد نابجاییها در شبکه فلز افزایش داده میشود و در نتیجه مقاومت فلز افزایش مییابد. البته این افزایش مقاومت به قیمت کاهش انعطافپذیری و چکش خواری فلز است. به این کار که در آن با ایجاد تغییر شکل پلاستیکی تعداد نابجاییها در شبکه فلز زیاد شده و بدین ترتیب مقاومت فلز افزایش مییابد، سختی سازی با کار روی فلز (Work Hardening) گفته میشود.
طبقه بندی آلیاژهای فلزی
یکی از مفیدترین خواص یک فلز این است که میتواند با مقادیر اندک از عناصر فلزی یا نافلزی دیگر مخلوط شود و این کار باعث بهبود مشخصات فلز اولیه گردد. به فلزاتی که با مخلوط کردن عناصر مختلف ساخته میشوند آلیاژ (Alloy) گفته میشود. به طور معمول فلزات و آلیاژهای آنها را بسته به این که فلز اصلی آنها آهن است یا فلزی دیگر به دو دسته آهنی (Ferrous) و غیرآهنی (Non-Ferrous) تقسیم میکنند. به طور مثال برنج یک آلیاژ غیرآهنی است که از مس و روی ساخته میشود. برنج از 65 درصد مس و 35 درصد روی تشکیل شده است. البته گاهی اوقات عناصر دیگری مانند فسفر، سرب، آلومینیوم، سیلیسیوم یا منگنز نیز اضافه میشوند. برنج بیشتر به خاطر ظاهر زیبایی که دارد و همچنین امکان ماشین کاری خوبی که داراست مورد استفاده قرار میگیرد.
آلیاژهای آلومینیوم نیز در مهندسی بسیار مهم هستند. این آلیاژها معمولا به خاطر استحکام بالایی که به نسب وزن و قیمت مناسب از خود نشان میدهند مورد استفاده قرار میگیرند. عناصری که معمولا در آلیاژهای آلومینیوم استفاده میشوند، مس، منگنز، سیلیکون، روی و منیزیم هستند. آلیاژهای آلومینیوم بسته به این که قرار است برای قالب گیری (Cast Aluminum Alloys) مورد استفاده قرار گیرند و یا برای این که بر روی آنها کار شود (Wrought Aluminum Alloys) طبقهبندی میشوند. آلیاژهایی که برای قالب گیری ساخته میشوند تنها ذوب میشوند و به همراه عناصر افزودنی دیگر در قالب ریخته میشوند تا به شکل و ساختار مورد نظر درآیند. آلیاژهای که ساخته میشوند تا بر روی آنها کار شود، علاوه بر حرارت دیدن نیاز دارند که به صورت مکانیکی نیز بر روی آنها اعمالی انجام گیرد. این نوع آلیاژها در حالی که بسیار حرارت دیدهاند اما هنوز به صورت جامد هستند تحت نیروها و عملیات مکانیکی قرار میگیرند تا شکل و ساختار مورد نظر را پیدا کنند. طبقه بندی این آلیاژها توسط سیستم عددی مشخص صورت میگیرد. تشریح نوع عدد گذاری آلیاژهای مختلف آلومینیوم بحث مفصلی است و خود نیاز به یک مقاله مستقل دارد. بنابراین صحبت درباره آن خارج از دامنه صحبت این مقاله میباشد.
نگاهی دقیقتر به ساختار آلیاژهای آهن
در بین تمام فلزات احتمالا فولاد یا استیل مهمترین آلیاژ در مهندسی است. آهن خالص نرمتر از آن است که در سازهها و ساختمانهای مکانیکی و عمرانی مورد استفاده قرار گیرد. اما آهن میتواند با مقدار کمی کربن و در بعضی موارد با عناصر دیگر مخلوط شود و فولاد را بسازد. آلیاژی که ویژگیهای فوقالعاده خوبی دارد. بسته به میزان استفاده از کربن و دیگر عناصر، فولاد در دستههای مختلفی طبقه بندی میشود. فولاد کم کربن یا فولاد نرم تا حداکثر 0.25 درصد کربن در خود دارد. فولاد نرم مقاومت خیلی بالایی ندارد اما انعطافپذیر و چکشخوار است و به نسبت قیمت پایینی دارد. فولاد با کربن متوسط در خود 0.25 تا 0.6 درصد کربن دارد. فولاد با کربن بالا شامل 0.6 تا 2 درصد کربن است. از آنجایی که دو نوع آلیاژهای فولاد با کربن متوسط و بالا، کربن بیشتری در خود دارند مقاومتر هستند. این نوع فولادها میتوانند سادهتر به روشهای حرارتی مختلف مانند غوطه وری یا کوئینچینگ (Quenching روشی است که در آن قطعه فولادی تا دمای بالاتر از دمای کریستال شدن و کمتر از دمای ذوب گرم میشود و سپس توسط مادهای به سرعت خنک میشود. معمولا از هوای فشرده، آب، روغن یا آب نمک به عنوان این ماده خنک کننده استفاده میشود.) و آبدیده کردن یا تمپرینگ (Tempering روشی است که برای کاهش مقاومت آلیاژ و افزایش انعطافپذیری و چکشخواری آن اجرا میشود. در این روش معمولا آلیاژی را که قبلا به روش غوطهوری سخت شده است را تا مرز دمای بحرانی آن گرم میکنند.) مقاوم سازی شوند. با اختلاط کربن بین 2 تا 4 درصد چدن به دست میآید. چدن در حالت مذاب روان روی خوبی دارد و کربن اضافه باعث پایین آمدن دمای ذوب آن میشود. این خصوصیتها باعث میشود چدن به راحتی قالب گیری شود. اما چدن حالت شکنندهتری نسبت به دیگر آلیاژهای آهن دارد. میتوانیم به مخلوط آهن و کربن عناصر دیگری نیز اضافه کنیم تا ویژگیهای دیگری در آلیاژ ایجاد شود. به طور مثال برای به دست آوردن فولاد ضدزنگ (Stainless Steel) به مخلوط عنصر کروم اضافه میشود. معمولترین فولاد ضدزنگ، فولاد ضدزنگ 304 است که شامل 18 درصد کروم و 8 درصد نیکل است.
آلیاژها با ذوب کردن توامان فلز پایه (فلز اصلی آلیاژ که بیشترین سهم مخلوط را دارد) و عناصر آلیاژساز (عناصر ناخالصی که سهم کمتری نسبت به فلز پایه در مخلوط را به خود اختصاص میدهند) مختلف دیگر ساخته میشوند. بسته به اندازه اتمهای ناخالصی این آلیاژها میتوانند از نوع آلیاژهای بیننشینی یا آلیاژهای جایگزینی باشند. فولاد از نوع آلیاژهای بیننشینی است، چون شعاع اتم کربن بسیار کمتر از شعاع اتم آهن است. شعاع اتم آهن 126 پیکومتر و شعاع اتم کربن 70 پیکومتر است. وجود عناصر آلیاژساز باعث به هم ریختگی شبکه کریستال میشود. این به هم ریختگی باعث جلوگیری از حرکت نابجاییها میگردد. در نتیجه وجود عناصر آلیاژساز باعث بالا رفتن مقاومت آلیاژ میشود. به این روش مقاوم سازی روش مقاوم سازی محلول جامد (Solid Solution Strengthening) گفته میشود. در این روش از عناصر آلیاژساز در شبکه فلز اصلی استفاده میشود. وجود اتمهای عناصر آلیاژساز محدودیتی را برای شبکه فلز اصلی ایجاد میکنند و از حرکت نابجاییها در طول جسم جلوگیری مینمایند.
اما عناصر آلیاژساز همیشه امکان حل شدن کامل در شبکه اتمی فلز اصلی را ندارند. اگر عنصر آلیاژساز بیشتر از یک حد خاص به نام حد اشباع به شبکه فلز اصلی اضافه شود، دیگر نمیتواند به صورت یکنواخت در شبکه فلزی توزیع شود. در این حالت این عناصر میتوانند به صورت جدا دربیایند و تشکیل بخشها یا فازهای همگن جداگانهای در ساختار اتمی فلز دهند. این بخشها یا فازها ترکیب متفاوتی دارند. روشهای مختلفی در به کارگیری ذرات تولید کننده بخش یا فاز ثانویه در شبکه فلز وجود دارد. وجود این بخشها به شکل محسوسی مقاومت آلیاژ را افزایش میدهد. از آنجایی که مانند مرزهای حوزهها، مرزهای بین بخشها یا فازها از حرکت نابجاییها جلوگیری میکنند این افزایش مقاومت آلیاژ عجیب نیست. استفاده از عملیات حرارتی به منظور تولید عمدی فازی همگن با ذرات متفاوت با شبکه اصلی فلز، با هدف افزایش مقاومت آلیاژ، سخت کاری رسوبی (Precipitation Hardening) گفته میشود.
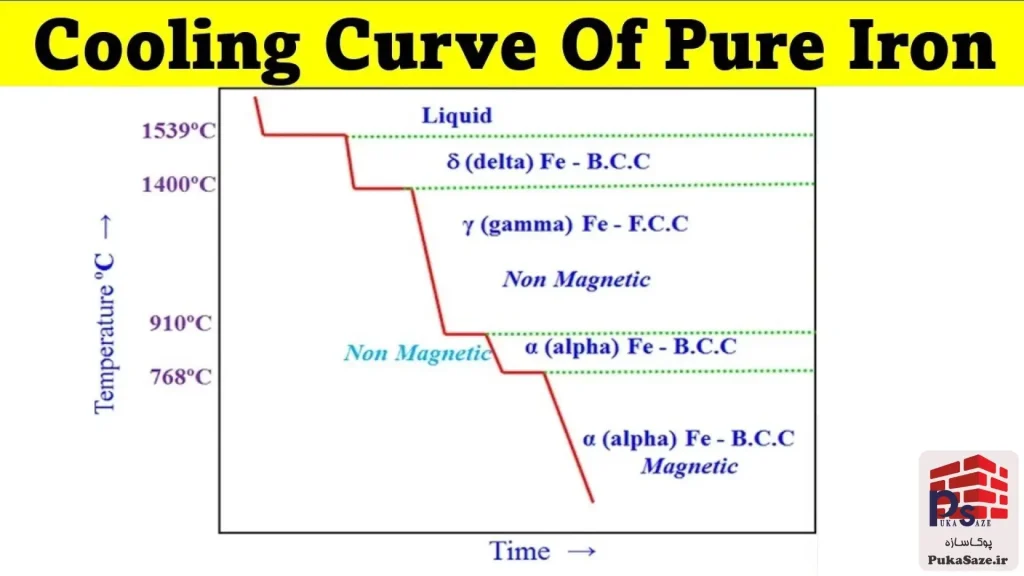
آهن خالص با افزایش دما تبدیلات فاز متفاوتی را تجربه میکند. در پایینتر از ۹۱۲ درجه سانتی گراد آهن در فرم BCC قرار دارد که به آن فریت (Ferrite) یا حالت آلفا (α) میگوییم. با افزایش دما به بالای ۹۱۲ درجه سانتی گراد آهن به فرم FCC در میآید، حالتی که به آن آستنیت (Austenite) یا حالت گاما (γ) میگوییم. سپس در دمای ۱۳۹۴ درجه سانتی گراد آهن دوباره به فرم BCC برمیگردد و در ۱۵۳۸ درجه سانتی گراد ذوب میشود. به این حالت آهن خالص بین دمای 1394 و 1538 درجه سانتی گراد حالت دلتا (δ) گفته میشود. در دمای بالاتر از 1538 آهن به صورت مایع است. فازهای جامد متفاوت آهن، دگرشکلهای آهن (Allotropes) گفته میشود و همان طور که بیان شد برای راحتی هر کدام از این فازها را با یک حرف یونانی نشان میدهند.
ما میتوانیم این نمودار را بسط دهیم تا نشان دهیم در هنگام وجود مقادیر مختلف کربن فازهای ماده چگونه تغییر میکنند. شکل حاصل نموداری است که به آن نمودار فاز آلیاژ آهن – کربن (Iron-Carbon Phase Diagram) گفته میشود. به خاطر طبیعت ساختار BCC فریت تنها میتواند مقدار اندکی کربن میان نشینی را در خود نگاه دارد. وقتی که میزان کربن از مقدار انحلالپذیری فریت بیشتر شود، اتمهای کربن اضافه باید به جایی دیگر بروند در نتیجه یک فاز جدید به نام سمنتیت (Cementite) در ادامه بخش فریت در نمودار برای درصدهای کربن بالاتر شکل میگیرد. سمنتیت یک ترکیب سخت و شکننده است که از یک اتم کربن در ازای هر سه اتم آهن تشکیل شده است. این مقدار کربن معادل ۶.۷ درصد وزنی کل ترکیب میباشد. در ماده دو فازه فریت – سمنتیت چگونگی دقیق ترکیب این دو فاز در ماده به مقدار کربن و فاکتورهای دیگری مانند این که ماده با چه سرعتی سرد شده است، بستگى دارد. به خاطر ساختار FCC آستنیت، نسبت به ساختار BCC فریت، آستنیت میتواند کربن بسیار بیشتری در خود نگه دارد. اما در اینجا نیز اگر اضافه شدن کربن ادامه یابد، مادهای دو فازه با فازهای آستنیت و سمنتیت خواهیم داشت. بسته به دما و مقدار کربن موجود چندین ترکیب فاز دیگر نیز وجود دارد. وجود فاز سمنتیت میتواند تاثیر قابل توجهی در افزایش مقاومت داشته باشد، چیزی که یکی از دلایل مقاومت بسیار بالاتر فولاد نسبت به آهن خالص است.



